| ← Октябрь 2012 → | ||||||
|
1
|
3
|
5
|
6
|
7
|
||
|---|---|---|---|---|---|---|
|
8
|
9
|
10
|
11
|
12
|
13
|
14
|
|
15
|
17
|
18
|
19
|
20
|
21
|
|
|
22
|
24
|
25
|
26
|
27
|
28
|
|
|
29
|
31
|
|||||
За последние 60 дней ни разу не выходила
Открыта:
27-08-2006
Статистика
0 за неделю
Фосфор и его соединения. Теория и задания по теме
|
Фосфор и его соединения. Теория и задания по теме 2012-10-14 09:29 yulianasol ЗАНЯТИЕ 3010-й класс (первый год обучения) Фосфор и его соединения П л а н
2. Краткая история открытия и происхождение названия. 3. Физические свойства. 4. Химические свойства. 5. Нахождение в природе. 6. Основные методы получения 7. Важнейшие соединения фосфора. Фосфор находится в главной подгруппе V группы периодической системы Д.И.Менделеева. Его электронная формула 1s22s2p63s2p3, это р-элемент. Характерные степени окисления фосфора в соединениях –3, +3, +5; наиболее устойчивой является степень окисления +5. В соединениях фосфор может входить как в состав катионов, так и в состав анионов, например:
Фосфор получил свое название благодаря свойству белого фосфора светиться в темноте. Греческое слово Фосфор может существовать в виде нескольких аллотропных модификаций, наиболее устойчивыми из которых являются белый, красный и черный фосфор. Молекула белого фосфора (наиболее активного аллотропа) имеет молекулярную кристаллическую решетку, в узлах которой находятся четырехатомные молекулы Р4 тетраэдрического строения. Белый фосфор мягкий, как воск, плавится и кипит без разложения, обладает чесночным запахом. На воздухе белый фосфор быстро окисляется (светится зеленоватым цветом), возможно самовоспламенение мелкодисперсного белого фосфора. В воде нерастворим (хранят под слоем воды), но хорошо растворяется в органических растворителях. Ядовит (даже в малых дозах, ПДК = 0,03 мг/м3). Обладает очень высокой химической активностью. При нагревании без доступа воздуха до 250–300 °С превращается в красный фосфор. Красный фосфор – это неорганический полимер; макромолекулы Рn могут иметь как циклическое, так и ациклическое строение. По свойствам резко отличается от белого фосфора: не ядовит, не светится в темноте, не растворяется в сероуглероде и других органических растворителях, не обладает высокой химической активностью. При комнатной температуре медленно переходит в белый фосфор; при нагревании до 200 °С под давлением превращается в черный фосфор. Черный фосфор по виду похож на графит. По структуре – это неорганический полимер, молекулы которого имеют слоистую структуру. Полупроводник. Не ядовит. Химическая активность значительно ниже, чем у белого фосфора. На воздухе устойчив. При нагревании переходит в красный фосфор. Х и м и ч е с к и е с в о й с т в а Наиболее активным в химическом отношении является белый фосфор (но на практике предпочитают работать с красным фосфором). Он может проявлять в реакциях свойства как окислителя, так и восстановителя, например: Н2 (+):
О2 (+): 4Р + 3О2 4Р + 5О2 3Ca + 2P 3Na + P Cu + P Неметаллы (+):
но 2Р + 3I 6P + 5N2 Н2О (+):
Основные оксиды (–). Кислотные оксиды (–). Щелочи (+):
Кислоты (не окислители) (–). Кислоты-окислители (+): 3P (кр.) + 5HNO3 (разб.) + 2H2O = 3H3PO4 + 5NO P (кр.) + 5HNO3 (конц.) 2P (кр.) + H2SO4 (конц.) В п р и р о д е фосфор встречается в виде соединений (солей), важнейшими из которых являются фосфорит (Ca3(PO4)2), хлорапатит (Ca3(PO4)2∙CaCl2) и фторапатит (Ca3(PO4)2∙CaF2). Фосфат кальция содержится в костях всех позвоночных животных, обусловливая их прочность. Фосфор п о л у ч а ю т в электропечах, сплавляя без доступа воздуха фосфат кальция, песок и уголь: Сa3(PO4)2 + 3SiO2 + 5C К важнейшим соединениям фосфора относятся: фосфин, оксид фосфора(III), оксид фосфора(V), фосфорные кислоты. Ф о с ф и н Это водородное соединение фосфора, бесцветный газ с чесночно-рыбным запахом, очень ядовит. Плохо растворим в воде, но хорошо растворим в органических растворителях. Гораздо менее устойчив, чем аммиак, но является более сильным восстановителем. Практического значения не имеет. Для п о л у ч е н и я фосфина обычно не используют реакцию прямого синтеза из простых веществ; наиболее распространенный способ получения фосфина – гидролиз фосфидов: Сa3P2 + 6HOH = 3Ca(OH)2 + 2PH3 Кроме того, фосфин можно получить реакцией диспропорционирования между фосфором и растворами щелочей: 4P + 3KOH + 3H2O или из солей фосфония: PH4I PH4I + NaOH Химические свойства фосфина целесообразно рассматривать с двух сторон. Кислотно-основные свойства. Фосфин образует с водой неустойчивый гидрат, проявляющий очень слабые основные свойства: PH3 + H2O PH3 + HCl 2PH3 + H2SO4 Окислительно-восстановительные свойства. Фосфин – сильный восстановитель: 2PH3 + 4O2 PH3 + 8AgNO3 + 4H2O = H3PO4 + 8Ag + 8HNO3. О к с и д ф о с ф о р а(III) Оксид Р2О3 (истинная формула – Р4О6) – белое кристаллическое вещество, типичный кислотный оксид. При взаимодействии с водой на холоде образует фосфористую кислоту (средней силы): P2O3 + 3H2O = 2H3PO3
Поскольку фосфористая кислота является двухосновной, при взаимодействии триоксида фосфора со щелочами образуется два типа солей – гидрофосфиты и дигидрофосфиты. Например: P2O3 + 4NaOH = 2Na2HPO3 + H2O, P2O3 + 2NaOH + H2O = 2NaH2PO3. Диоксид фосфора Р2О3 окисляется кислородом воздуха до пентаоксида: P2O3 + O2 Триоксид фосфора и фосфористая кислота являются достаточно сильными восстановителями. Получают оксид фосфора(III) медленным окислением фосфора в недостатке кислорода: 4P + 3O2 2P2O3. О к с и д ф о с ф о р а(V) и ф о с ф о р н ы е к и с л о т ы Пентаоксид фосфора Р2О5 (истинная формула – Р4О10) – белое гигроскопичное кристаллическое вещество. В твердом и газообразном состояниях молекула существует в виде димера, при высоких температурах мономеризуется. Типичный кислотный оксид. Очень хорошо растворяется в воде, образуя ряд фосфорных кислот: метафосфорную: P2O5 + H2O = 2HPO3
пирофосфорную (дифосфорную): P2O5 + 2H2O = H4P2O7
ортофосфорную (фосфорную): P2O5 + 3H2O = 2H3PO4
Пентаоксид фосфора проявляет все свойства, характерные для кислотных оксидов, например: P2O5 + 3H2O = 2H3PO4, P2O5 + 3CaO может образовывать три типа солей:
Окислительные свойства для него не характерны, т.к. степень окисления +5 является для фосфора очень устойчивой. Получают пентаоксид фосфора при горении фосфора в достаточном количестве кислорода: 4P + 5O2 Ортофосфорная кислота Н3РО4 – бесцветное кристаллическое вещество, очень хорошо растворимое в воде, гигроскопична. Это трехосновная кислота средней силы; не обладает выраженными окислительными свойствами. Проявляет все химические свойства, характерные для кислот, образует три типа солей (фосфаты, гидрофосфаты и дигидрофосфаты): 2H3PO4 + 3Ca = Ca3(PO4)2 + 3H2 H3PO4 + Cu 2H3PO4 + 3CaO = Ca3(PO4)2 + 3H2O,
2H3PO4 + K2CO3 = 2KH2PO4 + CO2 В промышленности фосфорную кислоту п о л у ч а ю т экстракционным: Ca3(PO4)2 + 3H2SO4 = 2H3PO4 + 3CaSO4, а также термическим методом: Ca3(PO4)2 + 3SiO2 + 5C 4P + 5O2 P2O5 + 3H2O = 2H3PO4. К лабораторным методам получения ортофосфорной кислоты относят действие разбавленной азотной кислоты на фосфор: 3Р (кр.) + 5HNO3 (разб.) + 2Н2О = 3H3PO4 + 5NO взаимодействие метафосфорной кислоты с водой при нагревании: HPO3 + H2O В организме человека ортофосфорная кислота образуется при гидролизе аденозинотрифосфорной кислоты (АТФ): АТФ Качественной реакцией на фосфат-ион является реакция с катионом серебра; образуется осадок желтого цвета, не растворимый в слабокислых средах: 3Ag+ + 3AgNO3 + K3PO4 = Ag3PO4 Кроме вышеперечисленных фосфорных кислот (содержащих фосфор в степени окисления +5), для фосфора известно много других кислородсодержащих кислот. Приведем некоторые из важнейших представителей. Фосфорноватистая (НРО2Н2) – одноосновная кислота средней силы. Второе ее название – фосфиновая:
Соли этой кислоты называют гипофосфитами, или фосфитами, например KРО2Н2. Фосфористая (Н3РО3) – двухосновная кислота средней силы, немного слабее фосфорноватистой. Также имеет второе название – фосфоновая:
Ее соли называются фосфиты, или фосфонаты, например K2РО3Н. Дифосфорная (пирофосфорная) (Н4Р2О7) – четырехосновная кислота средней силы, чуть сильнее ортофосфорной:
Соли – дифосфаты, например K4P2O7. Тест по теме «Фосфор и его соединения»
а) кислород; б) азот; в) фосфор; г) сера. 2. При взаимодействии 42,6 г фосфорного ангидрида и 400 г 15%-го раствора гидроксида натрия образуется: а) фосфат натрия; б) гидрофосфат натрия; в) смесь фосфата и гидрофосфата натрия; г) смесь гидро- и дигидрофосфата натрия. 3. Сумма коэффициентов в уравнении электролитической диссоциации фосфата калия равна: а) 5; б) 3; в) 4; г) 8. 4. Число электронов на внешнем уровне атома фосфора: а) 2; б) 3; в) 5; г) 15. 5. Фосфор, полученный из 33 г технического фосфата кальция, сожгли в кислороде. Образовавшийся оксид фосфора(V) прореагировал с 200 мл 10%-го раствора гидроксида натрия (плотность – 1,2 г/мл) с образованием средней соли. Масса примесей в техническом образце фосфата кальция (в г) составляет: а) 3,5; б) 1,5; в) 2; г) 4,8. 6. Число а) 2; б) 12; в) 14; г) 10. 7. Число атомов водорода, содержащихся в 4,48 л (н.у.) фосфина равно: а) 1,2∙1023; б) 0,6∙1023; в) 6,02∙1023; г) 3,6∙1023. 8. При температуре 30 °С некая реакция протекает за 15 с, а при 0 °С – за 2 мин. Коэффициент Вант-Гоффа для данной реакции: а) 2,4; б) 2; в) 1,8; г) 3. 9. Ортофосфорная кислота может реагировать со следующими веществами: а) оксид меди(II); б)гидроксид калия; в) азотная кислота; г) цинк. 10. Сумма коэффициентов в реакции между фосфором и бертолетовой солью равна: а) 9; б) 6; в) 19; г) такая реакция невозможна. Азот и его соединения. Тест по теме 2012-10-14 09:56 yulianasol ЗАНЯТИЕ 32 10-й класс (первый год обучения) Азот и его соединения П л а н
2. Краткая история открытия и происхождение названия. 3. Физические свойства. 4. Химические свойства. 5. Нахождение в природе. 6. Основные методы получения. 7. Важнейшие соединения азота (аммиак, соли аммония, оксиды и кислоты азота). Азот N – элемент главной подгруппы V группы периодической системы. Это типичный неметалл с высокой электроотрицательностью (ЭО = 3,0). Электронная формула атома азота имеет вид 1s22s22p3, это р-элемент. Поскольку азот находится во втором периоде, для его атома невозможен переход в возбужденное состояние и распаривание электронов, поэтому азот никогда не проявляет валентность, равную пяти. Степени окисления лежат в широком диапазоне от –3 до +5, например:
В соединениях азот чаще всего входит в состав анионов, но образует также катион аммония:
Русское название азота произошло от греческого a – частица отрицания и zoos – живой – «нежизненный» и является исторически сложившимся, хотя и неверным. Название «азот» предложено А.Лавуазье, чтобы отразить основное свойство элемента – его непригодность для дыхания и жизни. Это название сохранилось в русском и французском языках. Латинское название азота nitrogenium переводится как «рождающий селитру». Ф и з и ч е с к и е с в о й с т в а Молекула простого вещества азота – N2. Это газ без цвета, вкуса и запаха, немного легче воздуха, плохо растворяется в воде, не поддерживает горения и дыхания. Конденсируется при –196 °С в бесцветную жидкость. Атомы в молекуле азота связаны очень прочной тройной ковалентной связью. Природный азот состоит из двух изотопов с массовыми числами 14 и 15. Х и м и ч е с к и е с в о й с т в а При обычных условиях азот является химически инертным соединением за счет очень прочной связи, образованной тремя парами электронов. Большинство химических реакций с участием азота протекают при повышенной температуре, например: Н2 (+): N2 + 3Н2 N2 + О2 Металлы (+): 6Li + N2 = 2Li3N, 2Al + N2 Неметаллы (+/–): N2 + 3F2 N2 + 2С N2 + S Н2О (–). Основные оксиды (–). Кислотные оксиды (–). Основания (–). Кислоты-неокислители (–). Кислоты-окислители (–). Соли (–). В виде простого вещества азот является основной составной частью воздуха (78 % по объему). В связанном виде азот находится в п р и р о д е в виде нитратов (селитр), а также входит в состав аминокислот, белков и других органических и неорганических соединений. В п р о м ы ш л е н н о с т и азот получают ректификацией жидкого воздуха (азот испаряется при более низкой температуре, чем кислород). В л а б о р а т о р н ы х у с л о в и я х азот получают термическим разложением нитрита аммония: NH4NO2 или дихромата аммония: (NH4)2Cr2O7 Кроме того, азот в лаборатории можно получить при взаимодействии некоторых металлов с азотной кислотой: 5Mg + 12HNO3 = 5Mg(NO3)2 + N2 а также некаталитическим окислением аммиака: 4NH3 + 3O2 Очень чистый азот получают термическим разложением азидов (солей азотистоводородной кислоты) натрия или бария: 2NaN3 В а ж н е й ш и е с о е д и н е н и я а з о т а А м м и а к NH3 – бесцветный газ с резким характерным запахом, ядовит, хорошо растворим в воде. Раствор аммиака в воде называется аммиачной водой или нашатырным спиртом (не путайте с нашатырем NH4Cl). В жидком состоянии молекулы аммиака связаны между собой водородными связями. Степень окисления азота в молекуле аммиака –3, валентность – III. В химическом отношении аммиак достаточно активен, склонен к реакциям присоединения, проявляет слабые осно’вные свойства, например: NH3 + Н2О = NH4OH, NH3 + НCl = NH4Cl,
Аммиак также можно рассматривать как очень слабую кислоту, например: 2NH3 (ж.) + 2Na = 2NaNH2 + H2 В окислительно-восстановительных реакциях аммиак может проявлять только восстановительные свойства:
Благодаря наличию неподеленной электронной пары у атома азота аммиак является хорошим лигандом и легко образует комплексные соединения, например: 4NH3 + CuSO4 = [Cu(NH3)4]SO4. Для получения аммиака в промышленности используют синтез Габера–Боша: N2 + 3Н2 К лабораторным методам получения аммиака относят: ∙ взаимодействие солей аммония с сильными основаниями: NH4Cl + KOH = KCl + NH3 ∙ гидролиз нитридов: Mg3N2 + 6Н2O = 3Mg(OH)2 + 2NH3 В природе аммиак выделяется при гниении веществ белковой природы. Катион аммония
Г и д р о к с и д а м м о н и я является слабым летучим основанием: OH– + Гидроксид аммония удобно использовать для осаждения амфотерных гидроксидов из растворов солей амфотерных металлов (щелочи в этом случае могут взаимодействовать с образующимся гидроксидом): AlCl3 + 3NH4OH = Al(OH)3 AlCl3 + 4NaOH (изб.) = Na[Al(OH)4] + 3NaCl. Все с о л и а м м о н и я хорошо растворимы в воде и проявляют общие свойства солей. К особым свойствам солей аммония относятся реакции их термического разложения, например: (NH4)2CO3 (NH4)2SO4 NH4NO3 NH4NO2 Качественной реакцией на аммиак является взаимодействие его с парами концентрированной соляной кислоты с образованием белого дыма NH4Cl: NH3 + HCl = NH4Cl. Качественной реакцией на катион аммония является взаимодействие с растворами щелочей при нагревании: 2NH4Cl + Ca(OH)2 О к с и д ы а з о т а. Известны следующие оксиды азота: несолеобразующие – N2O, NO; солеобразующие – N2O3, NO2 (N2O4), N2O5. Все они, кроме N2O, ядовиты. Все оксиды азота термически неустойчивы и при нагревании разлагаются с выделением кислорода. NO и NO2 являются одними из основных загрязнителей атмосферы. О к с и д а з о т а (I) N2O – бесцветный газ со слабым запахом и сладковатым вкусом, хорошо растворим в воде (без взаимодействия). В смеси с воздухом возбуждающе действует на нервную систему человека («веселящий газ»). Его также применяют в медицине в качестве анестезирующего средства. При высокой температуре разлагается: 2N2O Этот оксид несолеобразующий, при обычных условиях проявляет малую реакционную способность. В зависимости от условий может проявлять слабые окислительные или восстановительные свойства (окислительные свойства выражены сильнее), например:
Получить оксид азота(I) можно термическим разложением нитрата аммония: NH4NO3 О к с и д а з о т а (II) NO – бесцветный газ без запаха, плохо растворим в воде. Несолеобразующий оксид. На воздухе легко окисляется: 2NO + O2 = 2NO2, димеризуется при охлаждении: 2NO Получают монооксид азота следующими способами: ∙ при непосредственном взаимодействии азота и кислорода: N2 + O2 ∙ взаимодействием неактивных металлов с разбавленной азотной кислотой: 3Cu + 8HNO3 (разб.) = 3Cu(NO3)2 + 2NO ∙ каталитическим окислением аммиака: 4NH3 + 5O2 О к с и д а з о т а (III) N2O3 – легкокипящая (3,5 °С) жидкость синего цвета, хорошо растворимая в воде (с образованием азотистой кислоты). Термически очень неустойчив, уже при 25 °С и нормальном давлении 90 % его молекулы распадаются: N2O3 = NO + NO2. Проявляет свойства, характерные для кислотных оксидов, например: N2O3 + H2O = 2HNO2, N2O3 + 2KOH (разб.) = 2KNO2 + H2O, 2N2O3 + O2 = 4NO2. О к с и д а з о т а (IV) NO2 – при комнатной температуре бурый газ (в промышленности получил название «лисий хвост») с характерным запахом; очень токсичен, его присутствие в атмосфере вызывает отек легких; с понижением температуры димеризуется и превращается в жидкий бесцветный димер (тетраоксид диазота). Хорошо растворим в воде. Смешанный оксид, которому условно отвечают две кислоты – азотная и азотистая: 2NO2 + H2O = HNO2 + HNO3. Похожим образом протекают реакции со щелочами: 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O. При взаимодействии NO2 с водой в присутствии кислорода образуется только азотная кислота: 4NO2 + 2H2O + О2 = 4HNO3. Диоксид азота является хорошим окислителем, например:
Получают диоксид азота следующими способами: ∙ окислением оксида азота(II): 2NO + O2 = 2NO2; ∙ взаимодействием неактивного (по положению в ряду напряжений) металла с концентрированной азотной кислотой: Cu + 4HNO3 (конц.) = Cu(NO3)2 + 2NO2 ∙ термическим разложением нитратов металлов средней активности: 2Pb(NO3)2 О к с и д а з о т а (V) N2O5 – бесцветное кристаллическое вещество, при комнатной температуре разлагается, хорошо растворяется в воде с образованием азотной кислоты: N2O5 + H2O = 2HNO3. Термически неустойчивый оксид: 2N2O5 Проявляет свойства кислотного оксида, является сильным окислителем, например: 3N2O5 + Al2O3 N2O5 + NaOH (разб.) = 2NaNO3 + H2O,
Получают этот оксид взаимодействием пентаоксида фосфора и азотной кислоты: 2HNO3 + P2O5 = N2O5 + 2HPO3 или окислением моно- и диоксида азота озоном: 2NO2 + O3 = N2O5 + O2. А з о т с о д е р ж а щ и е к и с л о т ы. А з о т и с т а я к и с л о т а – HNO2 – слабая, неустойчивая кислота, существующая при низких температурах только в разбавленных растворах, при нагревании разлагается: 2HNO2 Азотистая кислота проявляет все свойства, характерные для слабых кислот, например: HNO2 2HNO2 + Ca = Ca(NO2)2 + H2 2HNO2 + CuO = Cu(NO2)2 + H2O, HNO2 + NaOH = NaNO2 + H2O. Азотистая кислота образует только один тип солей – нитриты. Нитриты в отличие от самой кислоты термически устойчивы, исключение составляет нитрит аммония: NH4NO2 В небольших дозах нитриты безвредны (например, их используют при производстве колбасных изделий), однако в больших дозах они ядовиты. В окислительно-восстановительных реакциях азотистая кислота и ее соли проявляют окислительно-восстановительную двойственность, например: 2HNO2 + 2HI = I2 HNO2 + H2O2 = HNO3 + H2O, 2NaNO2 + Na2S + 2H2SO4 = 2Na2SO4 + S + 2NO + 2H2O, 5KNO2 + 2KMnO4 + 3H2SO4 = 5KNO3 + K2SO4 + 2MnSO4 + 3H2O. А з о т н а я к и с л о т а HNO3 – бесцветная (при хранении желтеет) жидкость с резким запахом, гигроскопична. Безводная азотная кислота «дымит» на воздухе. С водой смешивается в любых соотношениях. Термически неустойчива, состав продуктов разложения зависит от температуры, например: 2HNO3 4HNO3 Составляя структурную формулу молекулы азотной кислоты, необходимо помнить, что одна из общих электронных пар азота и кислорода в равной степени распределена между двумя связями:
По кислотно-основным свойствам азотная кислота является одной из наиболее сильных кислот, в водных растворах полностью диссоциирует на ионы и проявляет многие свойства, характерные для кислот, например: HNO3 2HNO3 + ZnO = Zn(NO3)2 + H2O, HNO3 + NaOH = NaNO3 + H2O, 2HNO3 + Na2CO3 = 2NaNO3 + H2O + CO2 В то же время азотная кислота является одним из наиболее сильных окислителей. Продукты ее восстановления лежат в широком диапазоне и зависят от природы восстановителя, участвующего в реакции, и от концентрации кислоты. Окислительные свойства азотной кислоты очень сильно зависят от температуры и резко усиливаются при нагревании. Металлы в реакциях с азотной кислотой любой концентрации окисляются, как правило, до нитратов, а неметаллы – до своих высших гидроксидов. Азотная кислота любой концентрации не реагирует с золотом, платиной, вольфрамом. Золото и платина растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в объемном соотношении 1:3: Au + HNO3 (конц.) + 4HCl (конц.) = H[AuCl4] + NO Концентрированная HNO3 при взаимодействии с наиболее активными металлами (до алюминия) восстанавливается до N2O, например: 4Mg + 10HNO3 (конц.) = 4Mg(NO3)2 + N2O Концентрированная HNO3 при взаимодействии с менее активными металлами и с неметаллами восстанавливается до NO2, например: Cu + 4HNO3 (конц.) = Cu(NO3)2 + 2NO2 C + 4HNO3 (конц.) = CO2 Концентрированная HNO3 пассивирует алюминий, хром и железо, однако при очень сильном нагревании реакции с этими металлами возможны. Разбавленная HNO3 с активными металлами, а также с железом и цинком образует NH3 (очень разбавленная – NH4NO3), например: 4Mg + 9HNO3 (разб.) = 4Mg(NO3)2 + NH3 4Mg + 10HNO3 (оч. разб.) = 4Mg(NO3)2 + NH4NO3 + 3H2O. Разбавленная HNO3 c менее активными металлами и с неметаллами восстанавливается до NO, например: 3Cu + 8HNO3 (разб.) = 3Cu(NO3)2 + 2NO 3C + 4HNO3 (разб.) = 3CO2 Способы получения азотной кислоты: ∙ вытеснение из солей с помощью концентрированной серной кислоты: KNO3 (тв.) + H2SO4 (конц.) = KHSO4 + HNO3 ∙ дуговой способ – продувание воздуха через электрическую дугу и дальнейшее превращение NO в азотную кислоту: N2 + O2 2NO + O2 = 2NO2, 4NO2 + O2 + 2H2O = 4HNO3; ∙ аммиачный способ: 4NH3 + 5O2 2NO + O2 = 2NO2, 4NO2 + O2 + 2H2O = 4HNO3. Соли азотной кислоты – нитраты, или селитры, – хорошо растворимы в воде, проявляют все свойства, характерные для солей. Как и азотная кислота, нитраты являются сильными окислителями (в кислой среде окислительная способность нитратов сопоставима с разбавленной азотной кислотой), например:
При нагревании нитраты разлагаются, причем продукты разложения зависят от активности металла, входящего в состав нитрата. Нитраты щелочных металлов (кроме лития) разлагаются с образованием нитрита и кислорода, например: 2NaNO3 Нитраты лития и большинства металлов (от щелочно-земельных до меди включительно) разлагаются при нагревании с образованием оксида металла, диоксида азота и кислорода, например: 4LiNO3 2Cu(NO3)2 Нитраты неактивных металлов (после меди) разлагаются с образованием металла, диоксида азота и кислорода, например: Hg(NO3)2 Нитрат аммония разлагается с образованием оксида азота(I) и воды: NH4NO3 Тест по теме «Азот и его соединения» 1. В молекуле азота атомы связаны…
б) двумя в) двумя г) ковалентными связями по донорно-акцепторному механизму. 2. В лаборатории азот можно получить прокаливанием: а) нитрата аммония; б) нитрита аммония; в) дихромата аммония; г) сульфата аммония. 3. Какое количество азота можно получить из 1м3 воздуха? а) 22,4 моль; б) 1000 моль; в) 34,86 моль; г) азот нельзя получить из воздуха. 4. Валентность азота численно равна его степени окисления в молекуле: а) азота; б) азотной кислоты; в) аммиака; г) оксида азота(II). 5. При взаимодействии некоторого металла массой 2,64 г с азотом образовался нитрид металла массой 2,92 г. Неизвестный металл – это: а) алюминий; б) литий; в) стронций; г) натрий. 6. Валентность и степень окисления азота в ионе аммония соответственно равны: а) IV и +3; б) IV и –3; в) III и +3; г) III и –3. 7. При взаимодействии разбавленной азотной кислоты с медью получают: а) водород; б) оксид азота(II); в) оксид азота(IV); г) медь не реагирует с азотной кислотой. 8. Какие металлы не реагируют с концентрированной азотной кислотой на холоде? а) алюминий; б) золото; в) платина; г) серебро. 9. Какой объем диоксида азота (в л) выделится при взаимодействии азотной кислоты, полученной аммиачным способом из 112 л аммиака (н.у.) с медью? а) 112; б) 28; в) 224; г) 56. 10. Сумма коэффициентов в реакции термолиза нитрата свинца равна: а) 8; б) 4; в) 9; г) 7. |
| В избранное | ||

 1. Положение в таблице Д.И.Менделеева, строение атома.
1. Положение в таблице Д.И.Менделеева, строение атома.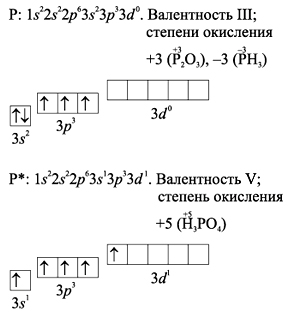










 1. Исключите «лишний» элемент из перечисленных по принципу возможности образования аллотропных модификаций:
1. Исключите «лишний» элемент из перечисленных по принципу возможности образования аллотропных модификаций: 1. Положение в таблице Д.И.Менделеева, строение атома.
1. Положение в таблице Д.И.Менделеева, строение атома.





 а) двумя
а) двумя 