| ← Октябрь 2012 → | ||||||
|
1
|
3
|
5
|
6
|
7
|
||
|---|---|---|---|---|---|---|
|
8
|
9
|
10
|
11
|
12
|
13
|
14
|
|
15
|
17
|
18
|
19
|
20
|
21
|
|
|
22
|
24
|
25
|
26
|
27
|
28
|
|
|
29
|
31
|
|||||
За последние 60 дней ни разу не выходила
Открыта:
27-08-2006
Статистика
0 за неделю
Периодический закон и система химических элементов Д.И.Менделеева
|
Периодический закон и система химических элементов Д.И.Менделеева 2012-09-27 20:40 yulianasol План
2. Периодический закон в формулировке Д.И.Менделеева. 3. Современная формулировка периодического закона. 4. Значение периодического закона и системы химических элементов Д.И.Менделеева. 5. Периодическая система химических элементов – графическое отражение периодического закона. Строение периодической системы: периоды, группы, подгруппы. 6. Зависимость свойств химических элементов от строения их атомов. 1 марта (по новому стилю) 1869 г. считается датой открытия одного из важнейших законов химии – периодического закона. В середине XIX в. было известно 63 химических элемента, и возникла потребность в их классификации. Попытки такой классификации предпринимали многие ученые (У.Одлинг и Дж.А.Р.Ньюлендс, Ж.Б.А.Дюма и А.Э.Шанкуртуа, И.В.Деберейнер и Л.Ю.Мейер), но лишь Д.И.Менделееву удалось увидеть определенную закономерность, расположив элементы в порядке возрастания их атомных масс. Эта закономерность имеет периодический характер, поэтому Менделеев сформулировал открытый им закон следующим образом: свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины атомной массы элемента.
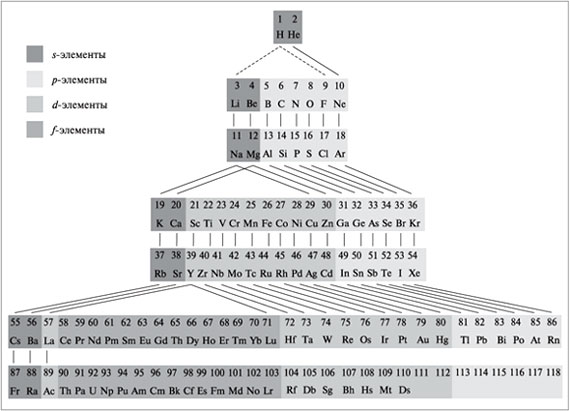
В системе химических элементов, предложенной Менделеевым, был ряд противоречий, которые сам автор периодического закона устранить не смог (аргон–калий, теллур–йод, кобальт–никель). Лишь в начале XX в., после открытия строения атома, был объяснен физический смысл периодического закона и появилась его современная формулировка: свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда ядер их атомов. Такую формулировку подтверждает и наличие изотопов, химические свойства которых одинаковы, хотя атомные массы различны. Периодический закон – один из основных законов природы и важнейший закон химии. С открытия этого закона начинается современный этап развития химической науки. Хотя физический смысл периодического закона стал понятен только после создания теории строения атома, сама эта теория развивалась на основе периодического закона и системы химических элементов. Закон помогает ученым создавать новые химические элементы и новые соединения элементов, получать вещества с нужными свойствами. Сам Менделеев предсказал существование 12 элементов, которые в то время еще не были открыты, и определил их положение в периодической системе. Свойства трех из этих элементов он подробно описал, и при жизни ученого эти элементы были открыты («экабор» – галлий, «экаалюминий» – скандий, «экасилиций» – германий). Кроме того, периодический закон имеет большое философское значение, подтверждая наиболее общие законы развития природы. Графическим отражением периодического закона является периодическая система химических элементов Менделеева. Существует несколько форм периодической системы (короткая, длинная, лестничная (предложена Н.Бором), спиралеобразная). В России наибольшее распространение получила короткая форма. Современная периодическая система содержит 110 открытых на сегодняшний день химических элементов, каждый из которых занимает определенное место, имеет свой порядковый номер и название. В таблице выделяют горизонтальные ряды – периоды (1–3 – малые, состоят из одного ряда; 4–6 – большие, состоят из двух рядов; 7-й период – незавершенный). Кроме периодов выделяют вертикальные ряды – группы, каждая из которых подразделяется на две подгруппы (главную – а и побочную – б). Побочные подгруппы содержат элементы только больших периодов, все они проявляют металлические свойства. Элементы одной подгруппы имеют одинаковое строение внешних электронных оболочек, что обусловливает их схожие химические свойства.
Период – это последовательность элементов (от щелочного металла до инертного газа), атомы которых имеют одинаковое число энергетических уровней, равное номеру периода.
Главная подгруппа – это вертикальный ряд элементов, атомы которых имеют одинаковое число электронов на внешнем энергетическом уровне. Это число равно номеру группы (кроме водорода и гелия). Все элементы в периодической системе разделяются на 4 электронных семейства (s-, p-, d-, Побочная подгруппа – это вертикальный ряд d-элементов, имеющих одинаковое суммарное число электронов на d-подуровне предвнешнего слоя и s-подуровне внешнего слоя. Это число обычно равно номеру группы. Важнейшими свойствами химических элементов являются металличность и неметалличность. Металличность – это способность атомов химического элемента отдавать электроны. Количественной характеристикой металличности является энергия ионизации. Энергия ионизации атома – это количество энергии, которое необходимо для отрыва электрона от атома элемента, т. е. для превращения атома в катион. Чем меньше энергия ионизации, тем легче атом отдает электрон, тем сильнее металлические свойства элемента. Неметалличность – это способность атомов химического элемента присоединять электроны. Количественной характеристикой неметалличности является сродство к электрону. Сродство к электрону – это энергия, которая выделяется при присоединении электрона к нейтральному атому, т. е. при превращении атома в анион. Чем больше сродство к электрону, тем легче атом присоединяет электрон, тем сильнее неметаллические свойства элемента. Универсальной характеристикой металличности и неметалличности является электроотрицательность (ЭО) элемента. ЭО элемента характеризует способность его атомов притягивать к себе электроны, которые участвуют в образовании химических связей с другими атомами в молекуле. Чем больше металличность, тем меньше ЭО. Чем больше неметалличность, тем больше ЭО. При определении значений относительной ЭО по шкале Полинга за единицу принята ЭО атома лития (ЭО(Li) = 1); самым электроотрицательным элементом является фтор (ЭО(F) = 4). В малых периодах от щелочного металла к инертному газу:
Все d-элементы данного периода похожи по своим свойствам – все они являются металлами, имеют мало различающиеся радиусы атомов и значения ЭО, поскольку содержат одинаковое число электронов на внешнем уровне (например, в 4-м периоде – кроме Cr и Cu). В главных подгруппах сверху вниз:
Тест по теме
2. Гипотетическая формула высшего оксида 115-го элемента периодической системы может иметь вид: а) ЭО2; б) Э2О5; в) ЭО4; г) Э2О115. 3. Порядковый номер элемента с наибольшей электроотрицательностью в 4 группе периодической системы: а) 6; б) 72; в) 82; г) 12. 4. Сколько энергетических уровней заполнено электронами в ионе калия? а) 4; б) 3; в) 6; г) 5. 5. При сгорании 1,86 г органического вещества образовалось 3,96 г углекислого газа и 0,54 г воды. Сколько всего атомов содержит молекула этого соединения, если известно, что его молярная масса меньше 200 г/моль? а) 3; б) 2; в) 15; г) 13. 6. В каких рядах химические элементы перечислены не в порядке уменьшения их атомных радиусов? а) Ca, Mg, Be; б) S, Cl, Br; в) Li, Na, K; г) B, Be, Li. 7. В порядке возрастания энергии ионизации расположены следующие элементы: а) Na, Mg, Al, Si; б) Na, Mg, Ca, Si; в) Na, Ca, Mg, Si; г) Si, Al, Mg, Na. 8. По происхождению (этимологии) названий «лишним» в перечне элементов будет: а) селен; б) теллур; в) ниобий; г) церий. 9. Одинаковое по абсолютной величине, но разное по знаку значение степени окисления в летучем водородном соединении и в высшем оксиде имеет элемент: а) бор; б) азот; в) сера; г) углерод. 10. Свойства высших оксидов элементов 3-го периода изменяются следующим образом: а) амфотерные, основные, кислотные; б) основные, кислотные, амфотерные; в) основные, амфотерные, кислотные; г) кислотные, амфотерные, основные. Ответы на задания теста здесь Основные химические законы 2012-09-27 20:43 yulianasol (Периодический закон Д.И.Менделеева рассматривается отдельно.)
1. Все вещества состоят из молекул, т.е. химическое соединение – это совокупность одинаковых (с химической точки зрения) молекул.
2. Молекулы состоят из атомов, причем молекулы простых веществ состоят из атомов одного вида (одного химического элемента), а молекулы сложных веществ – из атомов разных видов (разных химических элементов). 3. Атомы и молекулы находятся в непрерывном хаотическом движении. Закон постоянства состава вещества (Ж.Л.Пруст, 1799 г.). Качественный и количественный состав соединений молекулярной структуры является постоянным, независимо от способа получения соединения. Закон применим к соединениям с молекулярным строением, т е. к соединениям с ковалентными связями (большинство органических соединений, неорганические кислоты, газы и т.д.).
Закон сохранения массы (М.В.Ломоносов, 1748 г., А.Л.Лавуазье, 1789 г.). Масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате реакции. Этот закон является частным случаем общего закона природы – закона сохранения массы и энергии в закрытых системах.
Закон Авогадро (А.Авогадро, 1811 г., С.Канниццаро, 1858 г.) В равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
Следствия из закона Авогадро: 1) при одинаковых условиях равные количества вещества различных газов занимают одинаковые объемы; 2) при нормальных условиях, т.е. температуре (Т = 273 К (0 °С) и давлении р = 101,3 кПа (1 атм,
3) некоторые авторы формулируют еще одно следствие из закона Авогадро, применяемое при решении расчетных задач: относительной плотностью газа Х по газу Y называется величина, равная отношению молярной массы газа Х к молярной массе газа Y (при одинаковых условиях):
Закон эквивалентов (И.В.Рихтер, 1792 г.). Массы веществ, вступающих в химическую реакцию, прямо пропорциональны их эквивалентам.
Химический эквивалент элемента – такая его масса, которая соединяется с единицей массы водорода или с 8 единицами массы кислорода или замещает эти количества в их соединениях. Э = А/В, где А – атомная масса элемента; В – валентность элемента, например: Э(О) = 16/2 = 8. Эквивалентный объем любого бинарного газа равен 11,2 л/моль. На основе закона эквивалентов выведены формулы для расчета эквивалентных масс сложных веществ:
Э(оксида) = молярная масса оксида/(валентность элемента∙число атомов элемента в оксиде), например: Э(Al2O3) = 102/(3∙2) = 17; Э(кислоты) = молярная масса кислоты/основность кислоты, например: Э(H2SO4) = 98/2 = 49; Э(основания) = молярная масса основания/кислотность основания, например: Э(Ca(OH)2) = 74/2 = 37; Э(соли) = молярная масса соли/(валентность металла∙число атомов металла), например: Э(Na2SO4) = 142/(1∙2) = 71. Уравнение Менделеева–Клапейрона (уравнение состояния идеального газа) описывает соотношение между давлением газа, его объемом, количеством вещества и температурой: pV = где p – давление, кПа; V – объем, л; R = 8,314 Дж/(моль∙К) = 0,082 л∙атм/(моль∙К); Т – температура, К. Объединенный газовый закон (Клапейрона):
Тест по теме «Основные химические законы»
а) 22,4; б) 44,8; в) 56,0; г) 112. 2. Плотность паров серы по воздуху составляет 2,21. Молекула серы при этих условиях имеет следующую молекулярную формулу: а) S; б) S2; в) S6; г) S8. 3. В баллоне объемом 50 л при 20 °С находится аргон под давлением 80 атм. Масса этого аргона равна (в кг): а) 6,66; б) 8,93; в) 7,62; г) 9,13. 4. Масса порции карбоната натрия, в которой содержится 3,01∙1023 атомов натрия, равна (в г): а) 53; б) 26,5; в) 106; г) 41,5. 5. Объем (в л, н.у.) порции метана, содержащей 4,816∙1023 атомов водорода, равен: а) 4,48; б) 17,92; в) 35,84; г) 71,68. 6. Относительная плотность некоторого газа по воздуху равна 2. Чему равна плотность этого газа по гелию? а) 7,25; б) 14,5; в) 29; г) 58. 7. Эквивалент сульфата аммония равен: а) 132; б) 66; в) 264; г) 11,2. 8. При н. у. объем 10 г газообразного водорода больше объема 10 г жидкой воды приблизительно в: а) 11 200 раз; б) 22 400 раз; в) 44 800 раз; г) 2240 раз. 9. Абсолютная плотность (кг/м3) углекислого газа, измеренная при н.у., равна: а) 1,25; б) 1,96; в) 1,429; г) 1,2506. 10. Соотношение масс ионов в йодиде алюминия составляет: а) 0,54:5; б) 0,72:4,3; в) 0,54:7,62; г) 0,54:2,54. Ответы можно найти здесь: урок- повторение в 9 классе.Генетическая связь между классами неорганических соединений 2012-09-27 21:06 yulianasol
Подготовка учителей в сфере информационных и коммуникационных технологий 2012-09-29 20:38 yulianasol При всей актуальности (которая бесспорна) этого направления работы с кадрами трудно дать одинаковый перечень рекомендаций в силу того, что школы России очень по-разному развиты в области компьютеризации. В некоторых из них есть один компьютер, в других — по несколько стационарных компьютерных классов (которые в таком количестве не нужны), в третьих — проблема в том, что в школы привезли, как говорят, тонны умного железа, которое устаревает морально раньше, чем изнашивается физически, в четвертых — учителя овладели элементарной компьютерной грамотностью, но не знают, что с этим делать дальше, не знают, как развиваться в сфере информационных и коммуникационных технологий (НИТ). Попытаемся обозначить, как говорят в науке, точки бифуркации, то есть возможные точки роста, а уже каждый руководитель решит, что и в каком порядке отобрать для содержания методической работы в рассматриваемом направлении. Прежде всего, необходимо последовательно и разумно развивать материальную базу. Стационарные компьютерные классы следует использовать для уроков информатики и работы учащихся после уроков (прежде всего, дат тех, у кого дома нет компьютера). Разумеется, вся эта техника должна иметь выход в Интернет. Для того чтобы учителя всех предметов могли (тогда, когда это нужно) использовать компьютер на своих уроках, необходимо заняться приобретением не стационарных, а мобильных (передвижных) компьютерных классов. Совершенно очевидно, что физик не понесет свои приборы, химик — колбы с растворами, биолог — муляжи: и т.д. в стационарный компьютерный класс. Мобильный, компьютерный класс — это тележка с комплектом ноутбуков, оборудованных системой беспроводной связи (wereless), которая перевозится туда, куда нужно, в соответствии с заявками учителей. В идеале, комплект ноутбуков должен иметь каждый оборудованный предметный кабинет. ; Руководителям школы стоит подумать, как в течение нескольких лет обеспечить всех учителей компьютерами. Может быть кто-то из учителей сможет купить его самостоятельно, кто-то — в кредит, кто-то купит прибор, бывший в употреблении, кто-то воспользуется услугами Интернет- кафе и компьютерами, оборудованными в почтовых отделениях. Возможно, кому-то компьютер будет подарен как победителю учительской олимпиады, конкурса «Учитель года» или по результатам работы на августовской конференции. Где-то создадут так называемые электронные учительские или школьные методкабинеты, кому-то школа оплатит хостинг (размещение информации клиента на сервере; организация виртуальных веб-серверов). Необходимо искать все возможные варианты, чтобы обеспечить каждому учителю возможность развивать свое профмастерство, работая с компьютером тогда, когда это необходимо. Сюда же отнесем работу руководителей по обеспечению школ электронными версиями учебников, обучающими и контролирующими программами для учащихся (все это уже есть в продаже). По мере создания всей вышеназванной материальной вазы будет развиваться и собственно методическая дельность по подготовке учителей в сфере информационных и коммуникационных технологий. Здесь мы видим три возможных направления работы: — создание, накопление и использование учителем так называемых цифровых образовательных ресурсов для самостоятельного конструирования уроков; — применение компьютера в качестве технического средства обучения на уроках; - использование компьютера именно как интеллектуального средства для конструирования уроков. Накопление цифровых методических ресурсов означает создание в своем компьютере систематизированной (или бы сгруппированной как-то) базы данных в виде файлов , содержащих любые материалы для подготовки к урокам. Это могут быть задачи по темам, упражнения, цитаты, целые поурочные разработки или их фрагменты, отрывки из пособий. Словом, все то, что учитель позаимствовал с приобретенных дисков или разработки свои и других учителей школы, района, города, региона, страны, с кем была установлена связь через Интернет. Важно, чтобы через несколько лет у учителя была своя медиатека с вариантами поурочных разработок по каждой теме, каждому курсу, который он преподает. И все то же по воспитательной работе. В последнее время возникла ошибочная тенденция: компьютер используется только как TCQ и в большинстве случаев, где он вообще не нужен, где он применен в угоду требованию малограмотных чиновников от образования, провозгласивших: «Урок признается несовременным, если в нем не использован компьютер» (неправильная и вредная точка зрения). Прошу читателя вникнуть в нижеприведенный пример. Он отражает массовое заблуждение. Прошел очередной Всероссийский конкурс «Учитель года», и два члена жюри (мои знакомые) независимо друг от друга с восторгом рассказали об очень талантливом учителе, показавшем потрясшее их использование компьютера на уроке в 3-м классе. Рассмотрим фрагмент этого опыта. Сначала учитель дал возможность детям прочесть целиком на экране всем известный, хотя и коротенький, но очень поучительный рассказ JI.H. Толстого «Косточка» (был использован компьютер с мультимедийным проектором). Используя технические возможности компьютера, учитель убрал большую часть текста с экрана и оставил только те строки, из которых следовал, как сказали бы дидакты, объект ррочного усвоения, то есть главное, существенное. «Какова же главная идея этого рассказа?» — спросил учитель. Дети ответили: «Главная идея в том, что все тайное рано или поздно становится явным», что было в принципе правильно, но только это одна из главных идей. Других ответов дети не дали. Тогда учитель, используя опять же технические возможности компьютера, стал последовательно «возвращать» на экран другие строчки рассказа, и дети увидели, сколько еще ценных идей, смыслов открылось им в мудром коротеньком рассказе великого JI.H. Толстого и, что педагогически очень важно, назвали их. Не буду продолжать рассказывать детали этого действительно хорошего урока. Суть изобретения понятна, и использованная учителем собственно педагогическая технология тут оправдана. Но члены жюри рассказывали мне с восторгом именно о, якобы новаторском, применении компьютера. Обращаю внимание читателя: прежде, чем дойти до всероссийского уровня конкурса, этот учитель прошел школьный, районный, городской, краевой этапы, и везде у членов жюри, как я позже выяснил, он вызывал изумление именно использованием компьютера на уроке в 3-м классе. Члены жюри последнего всероссийского этапа, рассказавшие мне об этом учителе, поверьте, читатель, высоко профессиональные, очень грамотные и уважаемые мною педагоги, опыт которых отмечен самыми высокими званиями, степенями, наградами и т.п. Более того, я и сам был в восторге от кажущейся мне тогда талантливости именно в применении компьютера на уроке. Позже я рассказал об этом специалистам по НИТ,»и они, что называется, камня на камне не оставили от наших восторгов. Дело в том, что в показанном приеме с использованием компьютера ничего действительно нового и прогрессивно- ео нет, ибо все то же самое любой учитель мог сделать и 10, и 20, и 30, и 40 лет назад безо всякого компьютера (что, кстати, заметим, учителя и делали — прием описан в литературе). Дать детям возможность читать текст с экрана, убирать и восстанавливать нужные строки — прием замечательный, дидактически (педагогически) ценный, но… Его можно осуществить и за меньшее время, просто заклеивая фрагменты, написанные на доске, бумагой, а затем, открывая их. Это можно сделать легче и быстрее, чем на компьютере, с помощью слайдов, кодоскопа, эпидиаскопа и других старых известных технических средств. Компьютер тут ничего нового в собственно педагогическую технологию не привносит и является одним из средств в известном ряду, называемом «технические средства обучения». Так оправдано ли применение столь дорогой, интеллектуально мощной электронной техники, если все это можно было сделать (и делали всегда!) без нее? И есть ли действительно тут предмет для восхищения якобы творческим применением компьютера? Я хочу, чтобы за этим, наверняка введшим в заблуждение многих читателей, примером, учителя поняли: «Компьютер — это не только и не столько ТСО, обладающее свойствами своих предшественников. Компьютер — это, прежде всего, дорогостоящая интеллектуальная машина и именно в этом ее истинное достоинство, ее истинная ценность, которая, к сожалению, не используется. То, что я рассказал, позволит читателю быстрее понять, что же такое на самом деле действительно новые информационные и коммуникационные технологии (что, конечно же, не отменяет использование возможностей компьютера как ТСО). Использование самого компьютера как интеллектуального средства для конструирования уроков — это то, чего пока нет. Чтобы заинтересовать читателя, рассмотрим разработку плана урока по конкретной теме в конкретном классе. Чтобы урок был эффективным, чтобы дети усвоили материал, чтобы они были довольны, и учитель был удовлетворен детьми и собой, необходимо учесть множество факторов. Прежде всего, смысл и структуру содержания того, что предстоит объяснять; выделить в нем главное существенное; определить, какие задачи (кроме обучения) можно еще реализовать на этом уроке. Это могут быть задачи воспитания, развития, оздоровления, задачи профессионально-личностного саморазвития учителя, социализации, диагностические, исследовательские. Задачи, какими средствами (методы, формы, приемы) это можно сделать наилучшим образом и учесть при этом особенности класса (обученность, обучаемость, учебные и воспитательные возможности конкретных детей); учесть, наконец, наиболее развитые возможности личности самого учителя. И все это интегрирует мозг. Продуктом этой интегрирующей работы мозга является оптимальный план урока. Мало кто задумывался над тем, что эту сложнейшую творческую работу можно поручить… компьютеру. Если заложить в его базу знаний (есть и продается соответствующая программа) формализованные данные, отвечающие на вопросы: - «Чему надо научить?» — электронная «формула» параграфа; - «Кого надо научить?» — данные о детях конкретного класса; - «Кто будет учить?» — данные об учителе, то компьютер, если можно так выразиться, заменит мозг учителя. Он переработает, интегрирует названную информацию и сконструирует на экране оптимальный, с его точки зрения, вариант плана урока, который, возможно, устроит учителя или уж, во всяком случае, явится основой для конструирования. Можно не согласиться с компьютером и сообщить ему свое возражение. Тогда компьютер, на основе анализа причин несогласия, предложит новый вариант, пока не будет найден удовлетворяющий учителя. При этом компьютер — самообучающаяся машина; все выбранные варианты им запоминаются и в дальнейшем могут предлагаться следующему пользователю. И это не единственная интеллектуальная задача, которую компьютер сейчас может решать. Автором всей этой технологии является профессор Д.Ш. Матрос и его сотрудники из Челябинского госпедуниверситета, которые работают с учителями страны, создают вместе действительно новую практику образования, которой нет не только нигде в России, но и в мире. [*] Это действительно настоящее (истинное) нововведение, а не ретро- и не псевдоинновация.[†] [*] Подробнее читайте об этом см.: «Народное образование», 2008, № 8, С. 218-224. [†] E-mail: matros@cspu.ru; matros@matrossoft.ru; г. Челябинск, Пр. Ленина, 69; тел.: (351) 239-37-80, 239-37-79; тел./факс: (351) 239-37-84. Психолого-педагогические семинары 2012-09-29 20:50 yulianasol В реализации этой формы самое важное, пожалуй, — воз вращение к ее каноническому исполнению. Дело в том, что в последние двадцать лет в силу небрежности обращения с словом любое занятие, относящееся к повышению квалификации учителей, стали называть семинаром. Хотя в действительности занятие представляет собой либо курс лекций, либо деловую игру, либо конференцию по обмену опытом работы. Мне неоднократно приходилось слышать, как курс лекций по какой-то теме, который я читал, публично называли «Семинар М.М. Поташника» и были удивлены, когда я поправлял, говоря, что это не семинар, курс лекций. «А какая разница, как называть?» — недоумевали мне в ответ. Давайте разберемся, в чем разница. Лекция — это форма учебного занятия, состоящая в у ном, монологическом изложении предмета преподавай она может предполагать по ходу или в конце ответы лектора на вопросы слушателей, проводится одним человеком. Семинар же имеет другую структуру. Для него характерны следующие обязательные элементы: — четко сформулированная тема и каждого занятия их совокупности; — наличие подготовленных и заранее розданных р водителем семинара вопросов для обсуждения; <> — наличие списка литературы по теме семинара (учи вая загруженность учителей, всегда с указанием с ниц, относящихся к вопросам предстоящего занятия. Прежде, чем идти на семинар, учителя должны прочесть необходимую литературу, подготовиться к выступлению по приведенным вопросам (тезисы или конспект, или план) и обязательно выступить. А руководитель (ведущий, автор) семинара комментирует выступления, если нужно, то дополняет их и обязательно делает итоговое обобщение, выделяя, говоря учительским языком, объект прочного усвоения, то есть главное, существенное. Программу одного их семинаров мы приводим в качестве образца в Приложении 4 этой книги (см. стр. 429—438). Только то, что описано выше, и может называться семинаром. Итак, автор (руководитель) семинара должен сначала сделать его программу. Семинар, обеспечивающий профессиональный рост учителей, предусматривает их активное участие и выбирается как форма повышения квалификации в том случае, когда по его теме в школе имеется литература (достаточное количество экземпляров книг или их копий или организована работа с книгой по очереди, или текст есть в компьютере). Если нужной литературы в достаточном количестве нет, то для повышения Квалификации избирается другая форма методической работы. Руководителем семинара может быть подготовленный учитель, председатель методического объединения, директор школы или его заместитель, приглашенный специалист и др. Важно, чтобы этот человек был компетентным в теме семинара. Это все о семинаре как о собственно форме, которая должна быть наполнена содержанием. Последнее определяется темой по психологии, педагогике — любым областям знаний, касающихся ребенка, образовательного пресса, профессионального роста учителя. Галогены и их важнейшие соединения 2012-09-29 21:00 yulianasol ЗАНЯТИЕ 29 10-й класс (первый год обучения) Галогены и их важнейшие соединения П л а н
2. Происхождение названий. 3. Физические свойства. 4. Химические свойства (на примере хлора). 5. Нахождение в природе. 6. Основные методы получения (на примере хлора). 7. Хлороводород и хлориды. 8. Kислородсодержащие кислоты хлора и их соли. Галогены («солероды») расположены в VIIа подгруппе периодической системы. K ним относятся фтор, хлор, бром, йод и астат. Все галогены относятся к р-элементам, имеют конфигурацию внешнего энергетического уровня ns2p5. Поскольку на внешнем уровне атомов галогенов находится 1 неспаренныйр-электрон, характерная валентность равна I. Kроме фтора, у атомов всех галогенов в возбужденном состоянии может увеличиваться число неспаренных электронов, поэтому возможны валентности III, V и VII.
Cl: 1s22s22p63s23p53d0 (валентность I), Cl*: 1s22s22p63s23p43d1 (валентность III), Cl**: 1s22s22p63s23p33d2 (валентность V), Cl***: 1s22s22p63s13p33d3 (валентность VII). Галогены являются типичными неметаллами, проявляют окислительные свойства. Степень окисления галогенов в соединениях с металлами и водородом –1; во всех кислородсодержащих соединениях галогены (кроме фтора) проявляют степени окисления +1, +3, +5, +7, например:
Вниз по подгруппе изменяется агрегатное состояние галогенов, уменьшается растворимость в воде, увеличивается радиус атома, уменьшаются электроотрицательность, неметаллические свойства и окислительная способность (фтор – самый сильный окислитель). Для соединений галогенов: от Cl– к I–увеличивается восстановительная способность галогенид-ионов. В ряду бескислородных и кислородсодержащих кислот происходит усиление кислотных свойств:
Название фтора произошло от греческого слова По ф и з и ч е с к и м с в о й с т в а м фтор – трудносжижаемый газ светло-зеленого цвета, хлор – легко сжижающийся газ желто-зеленого цвета, бром – тяжелая жидкость красно-бурого цвета, йод – твердое кристаллическое вещество темно-фиолетового цвета с металлическим блеском, легко подвергается возгонке (сублимации). Все галогены, кроме йода, обладают резким удушливым запахом, токсичны. Х и м и ч е с к и е с в о й с т в а Все галогены проявляют высокую химическую активность, которая уменьшается при переходе от фтора к йоду. Химические свойства галогенов рассмотрим на примере хлора: Н2 (+):
(F2 – со взрывом; Br2, I2 – на свету и при повышенной температуре.) О2 (–). Металлы (+): 2Na + Cl2 = 2NaCl; 2Fe + 3Cl2
N2 + Cl2 Н2О (+):
Основные оксиды (–). Kислотные оксиды (–). Основания (+/–):
Kислоты (+/–): 2HBr + Cl2 = 2HCl + Br2, HCl + Br2 Соли (+/–): 2KBr + Cl2 = 2KCl + Br2, KCl + Br2 В п р и р о д е в свободном виде галогены не встречаются из-за высокой химической активности. Среди наиболее распространенных соединений хлора можно выделить каменную или поваренную соль (NaCl), сильвинит (KCl∙NaCl), карналлит (KCl∙MgCl2). Большое количество хлоридов содержится в морской воде. Хлор входит в состав хлорофилла. Природный хлор состоит из двух изотопов 35Cl и 37Cl. Подчеркнем, что в случае хлора число нейтронов в атоме возможно рассчитать только для каждого изотопа в отдельности: 35Cl, p = 17, e = 17, n = 35 – 17 = 18; 37Cl, p = 17, e = 17, n = 37 – 17 = 20. В п р о м ы ш л е н н о с т и хлор получают электролизом водного раствора или расплава хлорида:
Л а б о р а т о р н ы е м е т о д ы получения (действие концентрированной соляной кислоты на различные окислители): MnO2 + 4HCl (конц.) = MnCl2 + Cl2 2KMnO4 + 16HCl (конц.) = 2MnCl2 KClO3 + 6HCl (конц.) = KCl + 3Cl2 K2Cr2O7 + 14HCl (конц.) = 2CrCl3 + 3Cl2 Ca(ClO)2 + 4HCl (конц.) = CaCl2 + 2Cl2 Х л о р о в о д о р о д и х л о р и д ы Хлороводород (HCl) – бесцветный газ с резким запахом, тяжелее воздуха, хорошо растворим в воде (в 1 объеме воды растворяется 450 объемов хлороводорода). Молекула образована по типу ковалентной полярной связи. Водный раствор хлороводорода называется соляной кислотой. Kонцентрированная соляная кислота «дымит» на воздухе, максимальная концентрация хлороводорода в растворе составляет 35–36 %. Это сильная кислота, проявляющая все характерные свойства кислот: HCl 2HCl + Zn = ZnCl2 + H2 HCl + Cu 2HCl + CaO = CaCl2 + H2O, HCl + NaOH = NaCl + H2O, 2HCl + Na2CO3 = 2NaCl + H2O + CO2 Kачественной реакцией на соляную кислоту и ее соли (хлориды) является реакция с раствором нитрата серебра: Ag+ + Cl– —> AgCl AgNO3 + NaCl —> AgCl Хлороводород можно получить: ∙ прямым синтезом из водорода и хлора (синтетический способ):
∙ действием концентрированной серной кислоты на твердые хлориды – сульфатный способ (аналогично можно получить HF, но нельзя получить HBr и HI): NaCl (тв.) + H2SO4 (конц.) = HCl С ростом степени окисления хлора сила кислот резко возрастает. Так, хлорноватистая кислота очень слабая (слабее угольной), а хлорная кислота – самая сильная из всех известных кислот. K и с л о р о д с о д е р ж а щ и е к и с л о т ы х л о р а и и х с о л и
Хлорноватистая кислота (HClO) – слабая, очень неустойчивая.
Соли этой кислоты (гипохлориты) являются очень сильными окислителями. Наибольшее применение находит смешанная соль соляной и хлорноватистой кислот – хлорид-гипохлорит кальция (хлорная известь):
Хлорноватая кислота (HClO3) – существует только в разбавленных растворах. Сама кислота и ее соли (хлораты) являются сильными окислителями. Наиболее известной солью этой кислоты является хлорат калия (бертолетова соль). 5KClO3 + 6P = 3P2O5 + 5KCl, KClO3 + 3MnO2 + 6KOH = KCl + 3K2MnO4 + 3H2O, 4KClO3 + 3K2S = 4KCl + 3K2SO4. Многие соли кислородсодержащих кислот хлора термически неустойчивы, например: 2KClO3 4KClO3 3KClO KClO4
Тест по теме «Галогены и их важнейшие соединения»
а) Фтор; б) хлор; в) бромоводород; г) хлороводород. 2. Явление перехода вещества из твердого состояния в газообразное, минуя жидкое, называется: а) конденсация; б) сублимация; в) возгонка; г) перегонка. 3. Природный хлор представляет собой смесь изотопов с массовыми числами 35 и 37. Рассчитайте изотопный состав хлора, приняв его относительную атомную массу за 35,5. а) 75 % и 25 %; б) 24,4 % и 75,8 %; в) 50 % и 50 %; г) недостаточно данных для решения задачи. 4. Хлор можно получить, проводя электролиз: а) расплава хлорида калия; б) раствора хлорида калия; в) расплава хлорида меди; г) раствора хлорида меди. 5. Раствор фтороводорода в воде называют: а) жавелевой водой; б) плавиковой кислотой; в) белильной известью; г) фтороводородной кислотой. 6. Оксид хлора(V) является ангидридом следующей кислоты: а) хлорноватистой; б) хлорноватой; в) хлористой; г) хлорной. 7. При прокаливании бертолетовой соли в присутствии диоксида марганца в качестве катализатора образуются: а) хлорид калия и кислород; б) перхлорат калия и хлорид калия; в) перхлорат калия и озон; г) гипохлорит калия и хлор. 8. K подкисленному раствору, содержащему 0,543 г некоторой соли, в состав которой входят литий, хлор и кислород, добавили раствор йодида натрия до прекращения выделения йода. Масса выделившегося йода составила 4,57 г. Название исходной соли: а) гипохлорит лития; б) хлорит лития; в) хлорат лития; г) перхлорат лития. 9. В молекулах галогенов химическая связь: а) ковалентная полярная; б) ковалентная неполярная; в) ионная; г) донорно-акцепторная. 10. Хлор, в отличие от фтора, при определенных условиях может реагировать с: а) водой; б) водородом; в) медью; г) гидроксидом натрия. Источник информации и ответы на тест можно найти здесь Сера и ее соединения 2012-09-29 21:05 yulianasol ЗАНЯТИЕ 30 10-й класс (первый год обучения) Сера и ее соединения П л а н
2. Происхождение названия. 3. Физические свойства. 4. Химические свойства. 5. Нахождение в природе. 6. Основные методы получения. 7. Важнейшие соединения серы (сероводород, сероводородная кислота и ее соли; сернистый газ, сернистая кислота и ее соли; триоксид серы, серная кислота и ее соли). В периодической системе сера находится в главной подгруппе VI группы (подгруппа халькогенов). Электронная формула серы 1s22s2p63s2p4, это р-элемент. В зависимости от состояния сера может проявлять валентность II, IV или VI: S: 1s22s22p63s23p43d0 (валентность II), S*: 1s22s22p63s23p33d1 (валентность IV), S**: 1s22s22p63s13p33d2 (валентность VI). Характерные степени окисления серы –2, +2, +4, +6 (в дисульфидах, содержащих мостиковую связь –S–S– (например, FeS2), степень окисления серы равна –1); в соединениях входит в состав анионов, с более электроотрицательными элементами – в состав катионов, например:
Сера – элемент с высокой электроотрицательностью, проявляет неметаллические (кислотные) свойства. Имеет четыре стабильных изотопа с массовыми числами 32, 33, 34 и 36. Природная сера на 95 % состоит из изотопа 32S. Русское название серы произошло от санскритского слова cira – светло-желтый, по цвету природной серы. Латинское название sulfur переводится как «горючий порошок».1 Ф и з и ч е с к и е с в о й с т в а Сера образует три аллотропные модификации: ромбическая ( Если ромбическую или моноклинную серу нагреть до точки кипения (444,6 °С) и полученную жидкость вылить в холодную воду, то образуется пластическая сера, по свойствам напоминающая резину. Пластическая сера состоит из длинных зигзагообразных цепей. Эта аллотропная модификация неустойчива и самопроизвольно превращается в одну из кристаллических форм. Ромбическая сера – твердое кристаллическое вещество желтого цвета; в воде не растворяется (и не смачивается), но хорошо растворяется во многих органических растворителях (сероуглерод, бензол и т.д.). Сера обладает очень плохой электро- и теплопроводностью. Температура плавления ромбической серы +112,8 °С, при температуре 95,5 °С ромбическая сера переходит в моноклинную:
Х и м и ч е с к и е с в о й с т в а По своим химическим свойствам сера является типичным активным неметаллом. В реакциях может быть как окислителем, так и восстановителем. Н2 (+):
О2 (+): S + O2 Металлы (+): 2Na + S = Na2S, 2Al + 3S Fe + S Hg + S = HgS. С + 2S 2P + 3S S + Cl2 = SCl2, S + 3F2 = SF6, S + N2 Н2О (–). сера не смачивается водой. Основные оксиды (–). Кислотные оксиды (–). Основания (+/–):
S + Cu(OH)2 Кислоты (не окислители) (–). Кислоты-окислители (+): S + 2H2SO4 (конц.) = 3SO2 + 2H2O, S + 2HNO3 (разб.) = H2SO4 + 2NO S + 6HNO3 (конц.) = H2SO4 + 6NO2 Соли (–). В п р и р о д е сера встречается как в самородном состоянии, так и в виде соединений, важнейшими из которых являются пирит, он же железный, или серный, колчедан (FeS2), цинковая обманка (ZnS), свинцовый блеск (PbS), гипс (CaSO4∙2H2O), глауберова соль (Na2SO4∙10H2O), горькая соль (MgSO4∙7H2O). Кроме того, сера входит в состав каменного угля, нефти, а также в различные живые организмы (в составе аминокислот). В организме человека сера концентрируется в волосах. Серу, содержащуюся в свободном состоянии в горных породах, выплавляют из них в автоклавах с помощью водяного пара. В л а б о р а т о р н ы х у с л о в и я х серу можно получить, используя окислительно-восстановительные реакции (ОВР), например: H2SO3 + 2H2S = 3S 2H2S + O2 2S В а ж н е й ш и е с о е д и н е н и я с е р ы Сероводород (H2S) – бесцветный газ с удушающим неприятным запахом тухлых яиц, ядовит (соединяется с гемоглобином крови, образуя сульфид железа). Тяжелее воздуха, малорастворим в воде (2,5 объема сероводорода в 1 объеме воды). Связи в молекуле ковалентные полярные, sp3-гибридизация, молекула имеет угловое строение:
В химическом отношении сероводород достаточно активен. Он термически неустойчив; легко сгорает в атмосфере кислорода или на воздухе; легко окисляется галогенами, диоксидом серы или хлоридом железа(III); при нагревании взаимодействует с некоторыми металлами и их оксидами, образуя сульфиды:
2H2S + O2 2H2S + 3O2 H2S + Br2 = 2HBr + S 2H2S + SO2 2FeCl3 + H2S = 2FeCl2 + S H2S + Zn H2S + CaO В лабораторных условиях сероводород получают действием на сульфиды железа или цинка сильных минеральных кислот или необратимым гидролизом сульфида алюминия: ZnS + 2HCl = ZnCl2 + H2S Аl2SO3 + 6HOH Раствор сероводорода в воде – сероводородная вода, или сероводородная кислота. Слабый электролит, по второй ступени практически не диссоциирует. Как двухосновная кислота образует два типа солей – сульфиды и гидросульфиды:
например, Na2S – сульфид натрия, NaHS – гидросульфид натрия. Сероводородная кислота проявляет все общие свойства кислот. Кроме того, сероводород, сероводородная кислота и ее соли проявляют сильную восстановительную способность. Например: H2S + Zn = ZnS + H2 H2S + CuO = CuS
Качественной реакцией на сульфид-ион является взаимодействие с растворимыми солями свинца; при этом выпадает осадок сульфида свинца черного цвета: Pb2+ + S2– —> PbS Pb(NO3)2 + Na2S = PbS Оксид серы(IV) SO2 – сернистый газ, сернистый ангидрид – бесцветный газ с резким запахом, ядовит. Кислотный оксид. Связи в молекуле ковалентные полярные, sp2-гибридизация. Тяжелее воздуха, хорошо растворим в воде (в одном объеме воды – до 80 объемов SO2), образует при растворениисернистую кислоту, существующую только в растворе: H2O + SO2 По кислотно-основным свойствам сернистый газ проявляет свойства типичного кислотного оксида, сернистая кислота также проявляет все типичные свойства кислот: SO2 + CaO
H2SO3 + Zn = ZnSO3 + H2
H2SO3 + CaO = CaSO3 + H2O. По окислительно-восстановительным свойствам сернистый газ, сернистая кислота и сульфиты могут проявлять окислительно-восстановительную двойственность (с преобладанием восстановительных свойств). С более сильными восстановителями соединения серы(IV) ведут себя как окислители:
С более сильными окислителями они проявляют восстановительные свойства:
В промышленности диоксид серы получают: ∙ при горении серы: S + O2 ∙ обжигом пирита и других сульфидов: 4FeS2 + 11O2 2ZnS + 3O2 К лабораторным методам получения относятся: ∙ действие сильных кислот на сульфиты: Na2SO3 + 2HCl = 2NaCl + SO2 ∙ взаимодействие концентрированной серной кислоты с тяжелыми металлами: Cu + 2H2SO4 (конц.) = СuSO4 + SO2 Качественные реакции на сульфит-ион – обесцвечивание «йодной воды» или действие сильных минеральных кислот: Na2SO3 + I2 + 2NaOH = 2NaI + Na2SO4 + H2O, Ca2SO3 + 2HCl = CaCl2 + H2O + SO2 Оксид серы(VI) SO3 – триоксид серы, или серный ангидрид, – это бесцветная жидкость, которая при температуре ниже 17 °С превращается в белую кристаллическую массу. Ядовит. Существует в виде полимеров (мономерные молекулы существуют только в газовой фазе), связи в молекуле ковалентные полярные, sp2-гибридизация. Гигроскопичен, термически неустойчив. С водой реагирует с сильным экзо-эффектом. Реагирует с безводной серной кислотой, образуя олеум. Образуется при окислении сернистого газа:
SO3 + H2O = H2SO4 + Q, nSO3 + H2SO4 (конц.) = H2SO4∙nSO3. По кислотно-основным свойствам является типичным кислотным оксидом: SO3 + H2O = H2SO4, SO3 + CaO = CaSO4,
По окислительно-восстановительным свойствам выступает сильным окислителем, обычно восстанавливаясь до SO2 или сульфитов:
В чистом виде практического значения не имеет, является промежуточным продуктом при производстве серной кислоты. Серная кислота – тяжелая маслянистая жидкость без цвета и запаха. Хорошо растворима в воде (с большим экзо-эффектом). Гигроскопична, ядовита, вызывает сильные ожоги кожи. Является сильным электролитом. Серная кислота образует два типа солей: сульфаты и гидросульфаты, которые проявляют все общие свойства солей. Сульфаты активных металлов термически устойчивы, а сульфаты других металлов разлагаются даже при небольшом нагревании: Na2SO4 ZnSO4 4FeSO4 Ag2SO4 HgSO4 Раствор с массовой долей серной кислоты ниже 70 % обычно считается разбавленным; выше 70 % – концентрированным; раствор SO3 в безводной серной кислоте называется олеум (концентрация триоксида серы в олеуме может достигать 65 %). Разбавленная серная кислота проявляет все свойства, характерные для сильных кислот: Н2SO4 Н2SO4 + Zn = ZnSO4 + Н2 Н2SO4 (разб.) + Cu Н2SO4 + CaO = CaSO4 + H2O,
CaCO3 + Н2SO4 = CaSO4 + H2O + CO2 Концентрированная серная кислота является сильным окислителем, особенно при нагревании. Она окисляет многие металлы, неметаллы, а также некоторые органические вещества. Не окисляются под действием концентрированной серной кислоты железо, золото и металлы платиновой группы (правда, железо хорошо растворяется при нагревании в умеренно концентрированной серной кислоте с массовой долей 70 %). При взаимодействии концентрированной серной кислоты с другими металлами образуются сульфаты и продукты восстановления серной кислоты. 2Н2SO4 (конц.) + Cu = CuSO4 + SO2
5Н2SO4 (конц.) + 8Na = 4Na2SO4 + H2S Н2SO4 (конц.) пассивирует Fe, Al. При взаимодействии с неметаллами концентрированная серная кислота восстанавливается до SO2: 5Н2SO4 (конц.) + 2Р = 2H3PO4 + 5SO2 2Н2SO4 (конц.) + C = 2H2O + CO2 Контактный метод получения серной кислоты состоит из трех стадий: 1) обжиг пирита: 4FeS2 + 11O2 2) окисление SO2 в SO3 в присутствии катализатора – оксида ванадия:
3) растворение SO3 в серной кислоте с получением олеума: SO3 + H2O = H2SO4 + Q, nSO3 + H2SO4 (конц.) = H2SO4∙nSO3. Качественная реакция на сульфат-ион – взаимодействие с катионом бария, в результате чего выпадает белый осадок BaSO4. Ba2+ + SO42– —> BaSO4 BaCl2 + Na2SO4 = BaSO4 Тест по теме «Сера и ее соединения»
а) хорошие проводники электричества; б) относятся к подгруппе халькогенов; в) хорошо растворимы в воде; г) имеют аллотропные модификации. 2. В результате реакции серной кислоты с медью можно получить: а) водород; б) серу; в) сернистый газ; г) сероводород. 3. Сероводород – это: а) ядовитый газ; б) сильный окислитель; в) типичный восстановитель; г) один из аллотропов серы. 4. Массовая доля (в %) кислорода в серном ангидриде равна: а) 50; б) 60; в) 40; г) 94. 5. Оксид серы(IV) является ангидридом: а) серной кислоты; б) сернистой кислоты; в) сероводородной кислоты; г) тиосерной кислоты. 6. На сколько процентов уменьшится масса гидросульфита калия после прокаливания? а) на 22,6; б) на 41,1; в) гидросульфит калия термически устойчив; г) на 34,2. 7. Сместить равновесие в сторону прямой реакции окисления сернистого газа в серный ангидрид можно: а) используя катализатор; б) увеличивая давление; в) уменьшая давление; г) понижая концентрацию оксида серы(VI). 8. При приготовлении раствора серной кислоты необходимо: а) наливать кислоту в воду; б) наливать воду в кислоту; в) порядок приливания не имеет значения; г) серная кислота не растворяется в воде. 9. Какую массу (в г) декагидрата сульфата натрия необходимо добавить к 100 мл 8%-го раствора сульфата натрия (плотность равна 1,07 г/мл), чтобы удвоить массовую долю соли в растворе? а) 100; б) 1,07; в) 30,5; г) 22,4. 10. Для определения сульфит-иона в качественном анализе можно использовать: а) катионы свинца; б) «йодную воду»; в) раствор марганцовки; г) сильные минеральные кислоты. Источник информации и ответы к тесту здесь |
| В избранное | ||

 1. История открытия периодического закона и системы химических элементов Д.И.Менделеева.
1. История открытия периодического закона и системы химических элементов Д.И.Менделеева.

 1. Среди всех элементов главной подгруппы I группы элемент литий обладает:
1. Среди всех элементов главной подгруппы I группы элемент литий обладает:









 1. При н.у. равное число молекул содержат 5 г водорода и объем гелия, равный (в л):
1. При н.у. равное число молекул содержат 5 г водорода и объем гелия, равный (в л): 1. Положение в таблице Д.И.Менделеева, строение атома.
1. Положение в таблице Д.И.Менделеева, строение атома.









 1. Газ имеет плотность 3,485 г/л при давлении 1,2 атм и температуре 25 °С. Установите формулу газа.
1. Газ имеет плотность 3,485 г/л при давлении 1,2 атм и температуре 25 °С. Установите формулу газа. 1. Положение в таблице Д.И.Менделеева, строение атома.
1. Положение в таблице Д.И.Менделеева, строение атома.






 1. Сера и кислород – это:
1. Сера и кислород – это: